爱必信(上海)生物科技有限公司品牌商
14 年
手机商铺
- NaN
- 0
- 0
- 2
- 2
推荐产品
技术资料/正文
小爱手把手教学—3D 类器官培养及研究思路
400 人阅读发布时间:2022-12-23 14:33

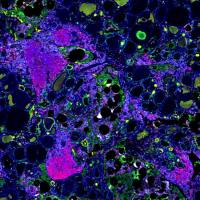
什么是类器官?

类器官的发展史

类器官的发展成果,主要集中在近十余年。
• 2009 年,Hans Clevers 实验室使用单个鼠 LGR5+肠干细胞在体外自组织成为具有肠隐窝-绒毛结构的肠类器官。
• 2011 年,由人多能干细胞和原代成体干细胞发育而来的肠类器官被成功制作。同年,由鼠胚胎干细胞培育而来的视网膜类器官被首次成功培育。
• 2012 年,由人多能干细胞发育而来的视网膜类器官成功培育。
• 2013 年,由人多能干细胞发育而来的脑类器官被成功培育。肝、肾、胰类器官被成功培育。
• 2014 年,前列腺、肺类器官被成功培育。
• 2015 年,乳腺、输卵管、海马体类器官被成功培育。
• 2020 年,蛇毒液腺类器官被成功培育。
类器官的分类
 |
 |
| 组织特异性成体干细胞来源的类器官 | ES/IPSC 来源的类器官 |
为什么要「类器官」
相比传统的二维培养模型,类器官代表着一种能够概括整个生物体生理过程的创新技术,具有更接近生理细胞组成和行为、更稳定的基因组、更适合于生物转染和高通量筛选等优势。而与动物模型相比,类器官模型的操作更简单,还能用于研究疾病发生和发展等机理。因而在器官发育、精准医疗、再生医学、药物筛选、基因编辑、疾病建模等领域都有广泛的应用前景。

类器官相关研究实验流程

实验材料
1、仪器设备
肠癌类器官培养试剂盒(abs9445),基质胶(abs9495),60 mm 细胞培养皿,100μm 滤筛,15 ml 离心管,1.5 ml EP 管若干,4 度冰盒,眼科剪刀,眼科镊。
|
组分 |
名称 |
规格 |
保存 |
|
A 组分 |
结直肠癌类器官缓冲液 |
100ml |
4℃ |
|
B 组分 |
结直肠癌类器官基础培养基 |
100ml |
4℃ |
|
C 组分 |
organo 原代酶解液 |
25ml |
4℃ |
|
D 组分 |
organo 消化液 |
25ml |
4℃ |
|
E 组分 |
organo 原代酶终止液 |
100ml |
4℃ |
|
F 组分 |
组织保存液 |
100ml |
4℃ |
|
G 组分 |
organo 冻存液 |
25ml |
4℃ |
实验方法
1、原代
(1)将组织放入含有特殊组织保存液 F 的组织取样瓶中放入冰盒 4℃,拍照并登记信息。
(2)取样瓶消毒,组织放入培养皿,结直肠癌类器官缓冲液 A 清洗三次后于培养皿中剪碎,大约 1 mm3 的组织块。
(3)癌组织用 organo 原代酶解液 C 消化,37℃ 震荡消化 10-20 min,(消化过程中随时观察消化情况)加入三倍体积 organo 原代酶终止液 E 终止消化。
(4)使用 100μm 孔径的筛网进行过滤,取少量滤液在镜下进行观察,可以看到明显的组织块,将滤液收集后于 300 g 富集离心 3-5 min 后移去上清,重新重悬离心。
(5)去除上清,使用适量基质胶(abs9495)进行重悬 (24 孔板为例,每孔 30ul)之后进行铺板(4℃ 下操作)拍照追踪定位。
(6)将铺好的板子放入 37℃ 培养箱中 10-15 min 成胶,添加培养基 B(恢复室温)进行培养。

2、类器官传代培养
(1)移液器吸去培养基,添加 4℃ 类器官缓冲液 A 放置一分钟。
(2)移液枪轻柔吹打基质胶,收集在 15 ml 离心管中,4℃ 静置 5 min。
(3)离心 5 min 弃去液体,添加适量类器官缓冲液 A 重悬移入 1.5 ml 离心管,300 g 离心 5 min 弃去液体或(添加适量消化液 D 作用 90-120S 终止,离心 5 min 弃去混合液)。
(4)类器官收集后,添加适量类器官冻存液 G,按 500 个/ml 密度冻存(或进行步骤 5)。
(5)类器官收集后,基质胶重悬,每孔 30μl 基质胶铺在 24 孔板中,放置培养箱中 10 min 添加 500μl 结直肠癌类器官培养基 B。
(1)在传代第二步,添加冻存液。
(2)500 个/ml 密度冻存,温度梯度降温-80 度,保存。
(1)取 10 ml 于 15 ml 离心管中。
(2)从液氮罐中取出冻存的肿瘤类器官细胞,快速置于 37℃ 水浴锅中融解。
(3)水浴融解过程中,需轻轻摇动冷冻管,以确保冻存液在 1-2 分钟内完全融解。
(4)将溶解后的类器官细胞快速转移至 15 ml 无菌离心管,使用移液管轻轻吹打 3 次,300 g 离心 3 分钟,然后除去上清液并收集类器官细胞沉淀。添加适量结直肠癌类器官缓冲液 A 重悬移入 1.5 ml 离心管 300 g 离心 5 min。
(5)基质胶重悬,每孔 20μl 基质胶铺在 24 控板中,放置培养箱中 10 min 添加 500μl 结直肠癌类器官培养基 B。
类器官的鉴定主要有形态学观察、基因分析、标志物检测、组织学染色这几种手段。

6、药敏
(1)药物准备阶段(药物种类、浓度)。
(2)在传代基础上接种到 96 孔板上,加药,牌照。在药物活性第 5 天检测细胞活性。

类器官研究相关技术及解决方案
CRISPR-Cas9 是细菌和古细菌在长期演化过程中形成的一种适应性免疫防御,可用来对抗入侵的病毒及外源 DNA。CRISPR-Cas9 基因编辑技术,则是对靶向基因进行特定 DNA 修饰的技术,这项技术也是用于基因编辑中前沿的方法。

研究背景:在印戒癌 (SRCC) 中常见 E-钙粘蛋白的表达缺失,CDH1 基因编码 E-钙粘蛋白,是钙依赖性细胞粘附蛋白,属于钙粘蛋白家族成员,CDH1 基因参与调节细胞粘附、迁移和上皮细胞增殖,其功能缺失导致细胞更容易侵袭与转移,该基因的突变与胃癌密切相关。因此,E-钙粘蛋白表达的缺失可能会增加患胃癌的概率。

通过 RNA-seq 测序,研究发现敲除后的肿瘤类器官与 SRCC 的细胞形态和细胞活力类似,同时还发现,CDH 1 KO hGO 细胞中 matrix metalloproteinase (MMP)基因上调,MMP 为水解细胞外基质蛋白质的酶类,包括基质中以及整合于质膜中的各种胶原酶和弹性蛋白酶等。然后科学家们对 95 例临床胃癌组织样本进行免疫荧光验证,结果显示,MMP-3 的确在临床样本中高表达。此外发现,CXCR4 从细胞核易位细胞膜上,加入 CXCR4 的配体 CXCL12 后,基因敲除的类器官生长期变长,在临床 SRCC 患者中纤维细胞分泌高表达 CXCL12。从而得出结论 MMP 和 CXCL12/CXCR4 有望成为 E -cadherin 缺陷性 SRCC 的新治疗靶点。

3. 单细胞测序中类器官技术应用
单细胞测序技术也是近年来受到青睐的明星技术,分别在 2018 年和 2019 年被 Science 期刊评为年度十大技术,被 Nature methods 评为年度方法。高通量单细胞测序技术通过对每个细胞遗传物质的分析,在单细胞分辨率下研究细胞的发育、分化,成为探索组织发育、肿瘤异质性等生物问题的重要方法。单细胞转录组测序与类器官结合,pubmed 关键词搜索已经达到 251 篇,类器官技术极大推动了器官发育、肿瘤研究、药物筛选、临床研究等多个领域的发展。


目前大多类器官本身并不具备血管化的结构。随着类器官体积的增长,类器官受限于氧气的缺失以及代谢废物的增加,可能导致的组织坏死。已有研究构建血管内皮细胞微环境的肿瘤类器官,将类器官肿瘤细胞和血管内皮细胞在 Matrigel 上共同培养,生成血管结构以期解决类器官血管化缺失的问题。

2. 类器官未来发展方向-共培养
2019 年 Nature Protocol 期刊发表了肿瘤类器官和免疫细胞共同培养的相关 protocol,可以体现和模拟出肿瘤微环境的部分特征。以上皮类器官和免疫细胞共培养模型为例,可通过在培养基中添加活化的免疫细胞、在组织消化成单细胞后和免疫细胞共同生长、添加 ECM 中的重组细胞因子等方法重塑类器官和免疫细胞的相互作用。
标准的形成,是在中国干细胞标准委员会及陈晔光院士的支持和推动下,由陈晔光院士团队联合国内几十家单位制定。编者联合学术界、产业界专家对肠癌类器官的培养,鉴定和质控等一系列过程进行了探讨,经过大量数据研究及充分研讨,最终形成国内人肠癌类器官标准,为类器官技术的临床研究和临床实践提供了规范和指导。